前言
骨在人体内部主要起到支撑作用,是一种具有愈 合和再生能力的硬组织[1]。由于骨的密度大、硬度高、破损后很难自然修复等特殊性,必须进行骨移植。 钛合金因具有轻质、弹性模量与人骨相近、耐腐蚀、生物相容性好等优点[2 − 3],被广泛应用于工程机械、航空航天和生物医学领域[4]。但是 TC4 基体对于金 黄色葡萄球菌的抗菌率仅为 14.5%[5],且钛及钛合金 具有生物惰性,与骨骼机械结合的方式会导致摩擦 产生碎屑,最终引发炎症,从而导致植入手术失败[6]。 相对于在提高钛合金种植体材料的骨结合、耐磨性和耐蚀性方面的研究,针对钛合金骨科植入体细菌 感染的研究仍处于早期阶段[7]。
植入手术术后感染是植入失败的主要原因之一,细 菌引起的相关植入物感染风险从 0.4% 到 16.1% 不等[8]。 引起细菌感染的重要原因是生物膜的形成[9] 及由粘 附的微生物聚集产生致密的胞外聚合物[10]。
因此,防 止或降低生物膜在植入过程中的形成具有重要作用。目前,对于提高钛及钛合金植入材料抗菌性能的 表面改性途径包括涂覆抗生素、制备有机抗菌剂和 无机抗菌剂涂层等技术来达到灭菌的作用[11]。研究 发现,钛合金表面制备依诺沙星涂层[12]、庆大霉素-HA涂层[13]、膦酸盐/季铵盐共聚物涂层[14] 等有机抗菌剂 涂层对钛合金的抗菌性能都有较大程度的提高。但 是,抗生素、有机抗菌剂的大量使用会导致细菌产生 耐药性且药物作用时间较短[15]。无机抗菌剂主要包 括Ag+,Cu2+,Zn2+,Co2+等,能够在人体内稳定发挥作用 且具有优良的抗菌性能和生物相容性。目前,在钛合金中添加无机抗菌金属元素的技术主要包括电弧 熔炼、真空等离子烧结、离子注入、气相沉积和激光 表面改性技术等,将无机抗菌剂掺入合金体系或者 表面,使植入材料获得抗菌性能。其中,激光表面改 性技术具有独特的技术优势,相对于电沉积、PVD/CVD技术,与基体材料具有较强的结合力。相对于热喷 涂技术,具有较小的热影响区[16],对基材的影响较小。 因此,激光表面改性技术具有广阔的应用潜力。
激光表面改性技术既可以通过高温热源对表面 进行重熔引发合金相转变或构建表面纹理化来提高 表面性能,又可以结合外源物质制备具有不同性能 的表面涂层[17]。激光作为一种新型能源,具有局部选 择性、能量密度高、节省材料、凝固快、稀释率低、热影响区窄、冶金结合强度高等优点[18],也可以对合 金的组织形态和析出相进行调控[19],被广泛应用于材 料加工领域。激光表面改性技术作为一种无机抗菌 剂植入技术,在表面工程中具有广泛的应用前景。
钛及钛合金作为主要的骨科植入材料,其抗菌性 的研究成为重中之重,如何利用激光表面改性技术,改善植入物的抗菌性能成为现阶段的研究热点。文 中综述了激光表面改性技术的分类,以及采用激光 表面改性技术对钛及钛合金进行表面合金化、表面 织构和激光熔覆处理,研究激光表面改性方式对钛 合 金抗菌性能的影响并对抗菌机理进行解释。
1、激光表面改性技术
激光表面改性技术利用激光热源与金属或非金 属进行相互作用,通过添加相同或不同材料或对材 料表面进行重熔来改善基体的表面性能,是一种清 洁、安全、高效率的加工技术[20],是光学、冶金学、电 子学、计算机学等为一体的高新技术,在现阶段具有 广阔的应用前景。
激光表面改性技术主要包括表面硬化、激光重 熔、织构化和激光熔覆等,分类如图 1 所示。
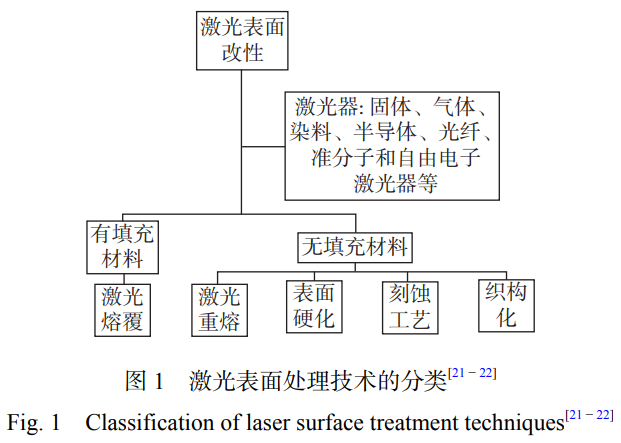
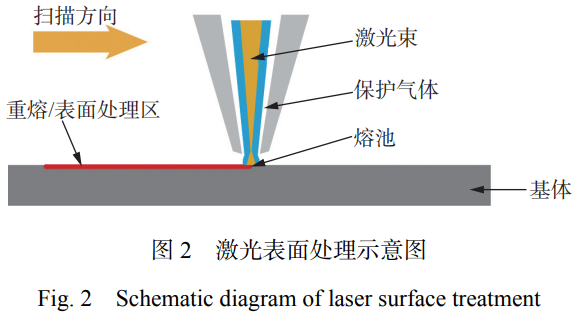
激光表面处理技术在保护气氛或者无保护气条 件下对材料进行表面加热或重熔,可以对材料表面 进行定向处理,其原理如图 2 所示。激光表面处理包 括激光重熔、激光合金化、激光纹理化和激光微纳加 工等技术。固体材料在受到激光束的作用下,有助 于通过诱导微观结构变化来进一步提高抗菌性能、表面硬度、耐磨性、耐腐蚀性等性能,从而实现表面 改性[23]。同时,激光表面处理可应用于制备微纳加工 结构、改善金属表面性能和加强固体材料粘结强度 等方面。
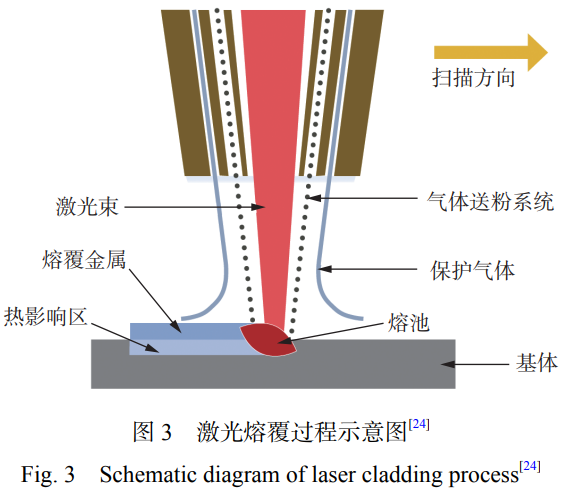
激光熔覆技术是利用激光束的高能量密度,将基 体材料熔化形成熔池,由保护气体携带金属粉末或 丝材同时注入熔池,从而将其熔覆在受热区域表面,形成具有冶金结合的功能性涂层,提高材料的表面 性能,其原理如图 3[24] 所示。激光熔覆技术是上世纪90 年代以来快速发展的表面改性技术,现阶段已经 得到广泛应用[18]。激光熔覆技术具有热输入能量集 中、热影响区小、变形小、基体能够与熔覆层形成冶 金结合、熔覆层稀释率低等优点[25 − 26]。激光熔覆技 术主要应用于提高基体耐磨性、耐蚀性、抗菌性和耐 高温性能等[27]。
2、激光表面处理钛合金抗菌涂层
激光本质上是电磁波的一种,按照波长可分为紫 外光、可见光和红外光[28]。根据激光器功率的不同,选择不同波长的激光对钛及钛合金进行处理。现阶 段,波长小于 355 nm 的短波长激光可以对钛及钛合 金进行切割;波长为 532 nm 的绿光激光多用在医疗 领域对钛及钛合金激光加工处理。激光表面处理技 术主要通过改变钛合金的表面化学成分和表面结构,对钛合金植入物的抗菌性能进行调控。在激光表面处理过程中,由于合金元素、表面结构 和熔覆体系的不同,对激光表面处理钛及钛合金的结 构和性能有不同程度的影响,从而达到不同的抗菌效果。
2.1 激光表面合金化
激光表面合金化技术(LSA)是利用激光热源将 基材熔化形成熔池,将高性能合金粉或气体与基体 发生反应形成一层新的合金化层,从而使材料具有 高性能[29]。
通过激光表面合金化技术在合金表面添加适当 含量的抗菌元素,可改变材料表面的合金成分。同 时,由于激光能量可以熔化涂层和部分底层基体,激 光表面合金化技术可以在合金层和基体之间形成牢 固的冶金结合。QIAO 等学者[30] 使用波长较短(0.9 μm)的高功率二极管激光器制备了 TiNi 与 Ag 的激光合 金化涂层。研究表明:通过合金化技术可以使涂层 中含有更多的 Ti2Ni,β-Ti 和 Ag 颗粒;在银含量(质量分数)为 4.6% 时,涂层的硬度提高了 109%;同时,合 金化后涂层释放的 Ag+和 Ag 颗粒显著提高了对大肠杆菌和金黄色葡萄球菌的抗菌效果。
在激光处理过程中,保护气体不仅可以降低空气 中氧气和水分等对激光表面处理的干扰和污染,提 高表面处理的质量和效率[31],还可以与基体发生反应,形成合金化涂层。由于氮和钛在热力学上存在有利 的相互作用,形成的氮化层对钛合金的硬度和摩擦 学性能有很大的提高[32]。钛的氮化物(TiN)、氧化物(TiO2)等[31] 都具有本征抗菌性能。邹洁等学者[33] 在 牙科钴铬合金表面制备一层 2.5 μm 厚度的TiN 涂层,之后对涂层进行耐腐蚀和抗菌性试验,发现:TiN 涂 层对变形链球菌或黏性放线菌有很好的抗菌性能。
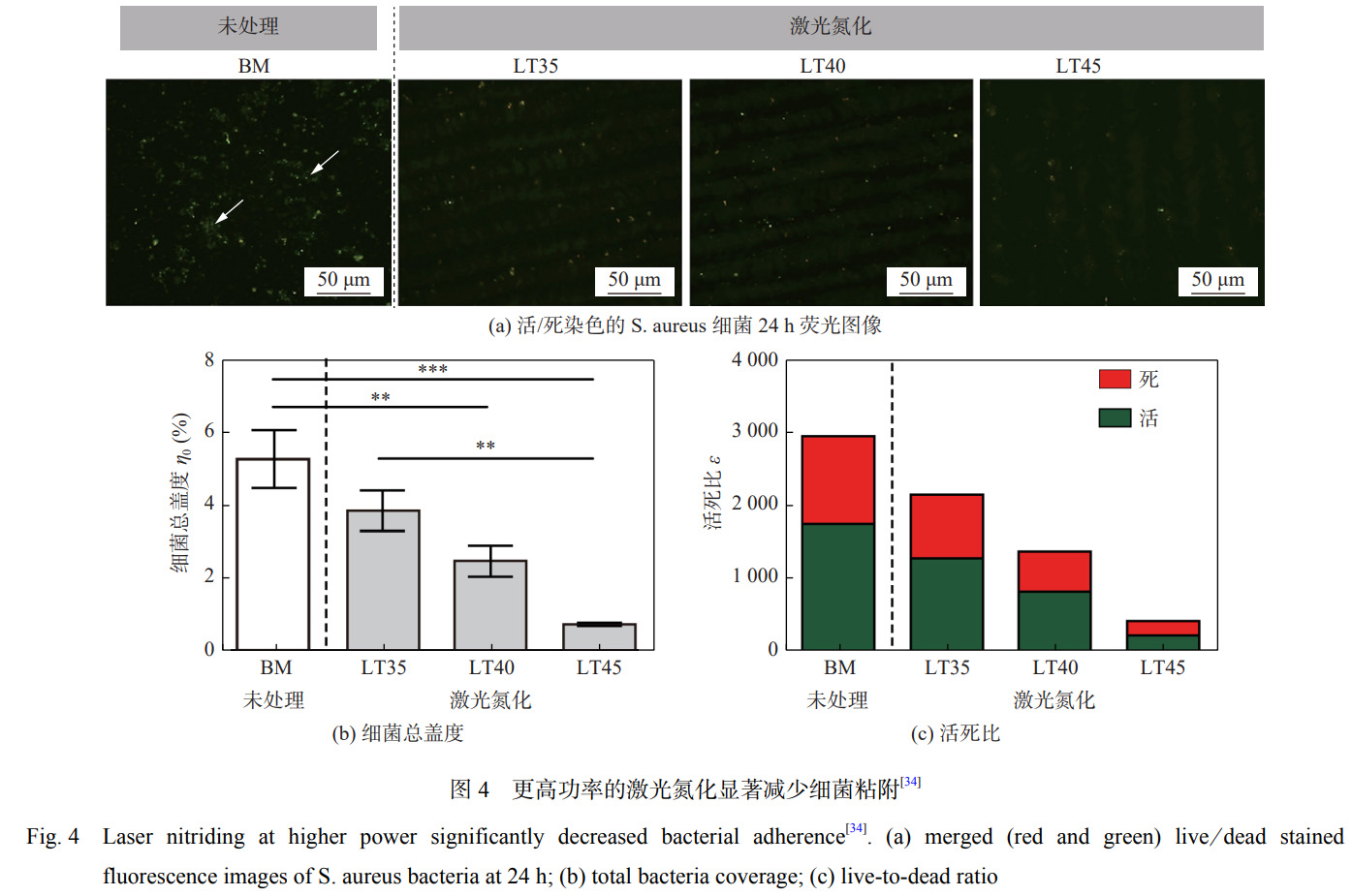
DONAGHY 等学者[34] 利用光纤激光技术在高纯N2 保护下对 TNZT(Ti-35Nb-7Zr-6Ta)合金进行处理,研究激光氮化处理对合金表面形貌、粗糙度、润湿角 以及抗菌性能的影响。结果表明:激光氮化处理后XRD 检测到较强的 TiN 峰值强度,能够显著提高表 面粗糙度至 1 180.2 nm,润湿角降低至 27.1°,亲水性 和生物相容性进一步提高,其抗菌效果如图 4[34] 所示,合金表面细菌覆盖率降低至 0.72%。
钛及钛合金相对于其他材料抗菌和耐腐蚀的主 要优点是可以在表面生成一层 TiO2 陶瓷膜[35]。研究 表明:钛合金在正常温度下暴露 1 年,所形成的 TiO2 氧 化膜的厚度为 6 nm,且与基体结合性很差,在较低的 剪切力作用下就会被破坏[7]。激光表面处理可以改 变氧化膜的厚度和表面粗糙度,进而提高合金的性能。
FATHI-HAFSHEJANI 等学者[36] 在氧气氛围内对 钛合金进行激光表面改性处理,钛合金基体表面形 成物相和形貌可控的高纯度 TiO2 涂层。由于晶体 TiO2涂层产生的光催化活性,具有不同相(锐钛矿、金红石)和 不同形态的 TiO2 涂层在增强骨整合和抗菌行为方面 表现出优异的性能。PARMAR 等学者[37] 通过对TC4进行纳秒激光和氧化处理。研究表明:纳秒激光处 理表面发生微坑形式的物理和化学变化,表面电荷发生变化,Ti 的氧化物含量增加,氧化可以促进激光 微织构对金黄色葡萄球菌的粘附和增殖能力的抑制。
钛与空气中的碳、氢等都有非常高的反应活性。CUNHA 等学者[38] 在空气中对钛进行激光表面处理,在进行 XPS 检测时,发现其有较高的碳峰,原因是空 气中含有较多的含碳污染物[39]。氩气作为一种常见 的惰性保护气体,其多用于激光焊接和激光熔覆过 程中防止有益元素的烧损和合金化[40],在钛及钛合金 表面激光处理用以提高抗菌性能中的应用较少。
2.2 激光表面织构
激光表面织构技术可以对钛合金进行表面结构 设计或者进行重熔处理,改善钛及钛合金的表面结 构。现阶段,通过激光表面织构技术可以在钛及钛 合金表面制备微米和纳米尺寸的结构或纹理结构,进而影响合金表面的氧化膜厚度和表面粗糙度,降 低表面载流子数量、提高表面峰度,有效地减少细菌 的黏附或灭活细菌[41]。
纳米级表面特征有利于减少细菌黏附和生长。CHAN 等学者[7] 通过连续波光纤激光器发射波长为1 064 nm近红外激光对商业纯钛(cp-Ti)和 TC4 进行激光 表面处理诱导纳米特征结构的产生,其处理后表面 如图5 所示。激光处理表面由波纹和放射状片层构 成的玫瑰状标记组成,2 种钛合金均表现出较强的抗 菌性能。从表面疏水性、膜成分、厚度和粗糙度等方 面对抗菌机理进行解释:①研究发现,金黄色葡萄球 菌是疏水性的,其水接触角为 72.2°[42],而经过激光处 理的表面表现出更强的亲水性,水接触角降低到30°~45°,减少了细菌的接触。②细菌与植入物表面 接触是在表面电荷与细菌的静电相互作用下进行吸 引,使细菌黏附在植入物表面,在氮气环境中进行激 光表面处理会增大表面膜层的厚度,减少表面载流 子的数量[43]。同时,表面膜层中存在大量的缺陷和空位,会造成电荷的富集,减少与细菌的相互作用[7]。 ③激光表面织构会增加材料的表面粗糙度,相同的 表面粗糙度具有不同的峰度(Rku)和偏度(Rsk)[44],激 光处理的钛合金表面具有更高的峰度和偏度,使表 面有更多的“尖刺”,减少细菌黏附的原理与蝉翼的 杀菌作用相似[45],通过细菌与材料的相互作用将其吸 附在表面,导致细菌的破裂和裂解。

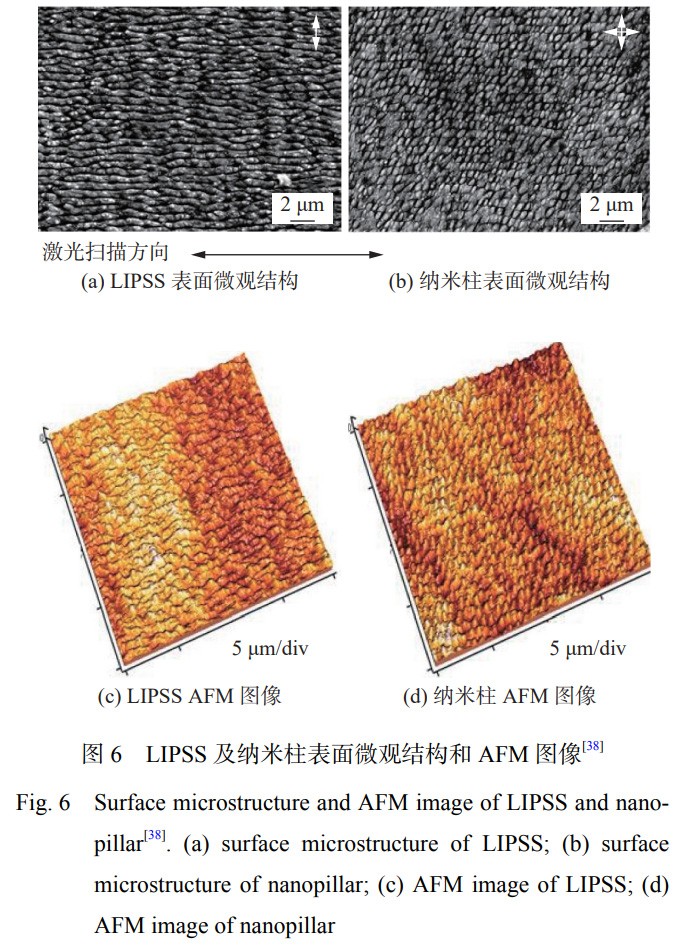
CUNHA 等学者[38] 采用 Yb: KYW 激光器、发射 波长为 1 030 nm、脉冲持续时间为 500 fs 的激光,在钛合金表面构建了激光诱导周期性表面纹理结构(LIPSS)和纳米柱 2 种表面织构,其表面结构如图 6所示,其 Ra 值分别为 0.3 μm 和 0.5 μm,润湿角分别为12.6°和 32.1°。对其进行细菌培养试验,未经激光处 理试样表面细菌覆盖率为 25%,激光处理后试样表面 金黄色葡萄球菌的覆盖率为 7%,对于细菌的生长有 较好的抑制作用。研究表明:金黄色葡萄球菌优先 附着于 1~4 nm 的钛合金表面[46],在 Ra 为 5~8 μm 的 样品上形成的生物膜比在抛光(Ra=30 nm)或机加工(Ra=0.5 μm)表面上更强烈[47]。细菌优先粘附在粗糙 度较高的表面,但也粘附在形貌特征大于细菌尺寸(一般为 1~2 μm)的表面。因此,激光诱导周期性表 面纹理结构可以通过改善钛合金表面的润湿角和粗 糙度降低细菌的黏附和增殖。综上所述,激光表面处理后钛及钛合金表面结构 对于减少细菌的黏附主要包括两方面:一是通过构 建具有特征尺寸小于细菌尺寸和具有非常致密的特 征表面,减少细菌与表面的接触面积,抑制细菌的定 植或刺破细菌,达到减少细菌滞留的目的;二是通过 增大表面的凹陷程度,细菌无法穿过凹陷与表面建 立稳定的连接,导致细菌只能黏附在个别的尖端,防 止 生物膜的形成。
2.3 激光熔覆抗菌涂层
激光熔覆技术可以在钛及钛合金表面熔覆不同 体系的成分,改善钛合金的性能。现阶段,激光熔覆 技术用于提高钛及钛合金抗菌性能的熔覆体系主要 包括生物医用金属材料(Ag,Cu,Nb,Zn,Ta 等[48])、生物陶瓷(HA,TiO2 等[49])。激光熔覆技术可以显著提 高钛及钛合金的抗菌性能,尤其是对金黄色葡萄球菌 和大肠杆菌等常见的致病菌有较好的抑制作用[50] 。
2.3.1 Ag 抗菌涂层
Ag 具有超强的抗菌性,被广泛应用于广谱杀菌 材料。SHI 等学者[51] 通过对高真空电弧炉熔炼的 TiAg合金进行抗菌性试验,发现:合金的抗菌性是由 于 Ti2Ag 和 Ag+的共同作用,且没有引起细胞毒性。CHEN等学者[52] 制成的 Ti-Ag 合金在经过热处理后,对金黄色葡萄球菌的抑制率高达 99%。表明:Ag 的 加入可以使合金获得较强且稳定的抗菌性能。
XUE 等学者 [53] 通过激光熔覆技术 在 Ti-20Zr10Nb-4Ta表面激光熔覆 Ag 箔,研究 Ag 微粒对于钛 合金抗菌性和相容性的影响,试验结果表明:当激光 功率为 50 W 和 70 W 时,经过处理的表面对于大肠杆 菌的抑菌率分别达到 96.3% 和 98.2%,对于金黄色葡 萄球菌的抑菌率均达到 100%,且随着激光功率的增 加,表面形成了钝化膜,粗糙度增大,具有良好的耐 腐蚀性能和生物相容性。ZHANG 等学者[54] 将 Ag 和ZnO 纳米颗粒掺入羟基磷灰石纳米粉体中,通过激光 熔覆技术沉积在 TC4 表面,对激光熔覆涂层的抗菌
性能和骨整合性能进行研究。研究发现:纳米 Ag 和HA 在熔覆层表面呈棒状,涂层与基体结合良好,最 大熔深达到 460 μm,涂层的最小润湿角约为 10.5°。 激光熔覆可以将复合涂层紧密地固定在 TC4 基体上,抑制了 Ag 离子的释放速率,缓解了高 Ag 浓度下的 细胞毒性[55],涂层具有优异的细菌抗性、成骨和骨整 合能力。MAHARUBIN 等学者[56] 通过激光加工净成 形工艺将混合均匀的 cp-Ti 粉和 Ag 粉采用同步送粉 方式在 cp-Ti 基体上制备银含量(质量分数)为 0.5%~2.0% 的 Ti-Ag 合金,通过 EDS 检测发现:
Ag 均匀地 分布在基体上。通过对不同 Ag 含量的试样进行金 黄色葡萄球菌和铜绿假单胞菌进行抗菌性试验,抗 菌效果随 Ag 含量的增加而增强 , 当 Ag 含量达 到1.5% 时,抗菌率分别达到 99.79% 和 99.96%,且在 Ag含量较低时,可以在不损害生物活性的前提下最小 化细菌感染的风险。
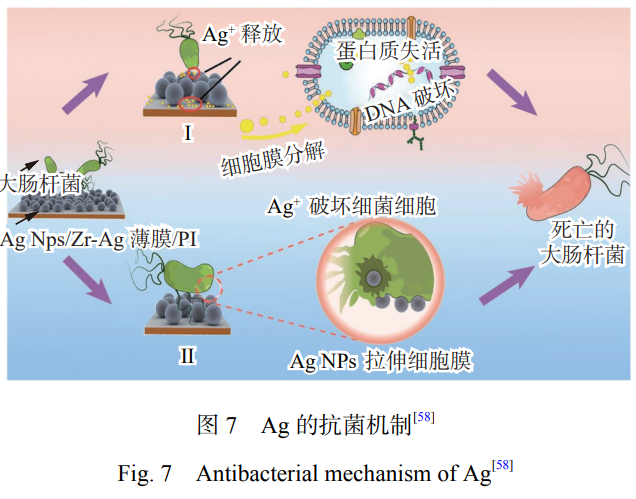
目前,关于 Ag 对微生物的抑制和杀伤途径主要 归结为以下观点[57],其抗菌原理如图 7[58] 所示。Ag能够抗菌的主要原因是能被菌类吸附,带正电荷的Ag+能与带负电荷的微生物之间产生静电吸引,从而 促使Ag+附着在细胞膜上[59],细菌的细胞膜在与 Ag接触几分钟后就会被完全破坏[60]。同时,Ag 能够与 细菌的蛋白质相互结合,破坏蛋白质的结构,阻碍细 菌的新陈代谢,从而失去活性[61]。Ag+浓度的提高会 导致细胞氧化反应的增加,微生物细胞氧化应激的 增加是 Ag+引起毒性作用的标志。由于 Ag 能够促进 细胞产生 ROS 和自由基,因此 Ag 具有强大的抗菌、抗真菌和抗病毒活性[62]。但是,抗菌性能与银含量不 存在线性关系,银含量过高时,并不会显著提高钛合 金的抗菌性能,反而可能产生细胞毒性[63] 。
2.3.2 Cu 抗菌涂层
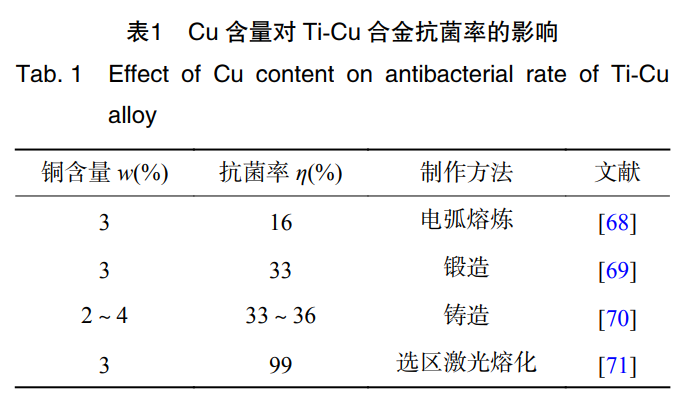
不同的金属材料杀菌能力也有所不同,其大小排序 为:Cu>Fe>Sn>Al>Zn>Co[64]。Cu 具有促进成骨细胞 分化,诱导血管生长的作用。同时,作为人体必需的微量 元素,有预防骨质疏松的作用[65]。ZHANG 等学者[66]通过采用等离子烧结技术制备的 Ti-Cu 合金对大肠 杆菌和金黄色葡萄球菌的抑制率达到 99%。有研究报道,只有 Ti-Cu 合金的 Cu 含量(质量分数)在 5% 及 以上,合金才具有抗菌率>99% 的抗菌性能[67],表 1 为 合金中 Cu 含量不同表现出的抗菌性能[68-71]。
JI 等学者[72] 采用激光选区熔化技术制备的 Ti- (3,5,7,10)Cu 合金(质量分数,%),Ti2Cu 相在晶界预先 形核并阻止晶粒长大,能够很好的起到细化晶粒的 作用。同时,由于激光选区熔化快速凝固的特点,Ti的平均晶粒尺寸为 7.4 μm,远小于常规铸造 Ti 的晶 粒尺寸,快速凝固导致表面收缩而产生的细小孔洞,增加了细菌与合金的接触面积,抗菌效果明显增加。合金具有较小的 Cu2+释放且有较高的抗菌率。Ti-Cu合金与细菌细胞膜的直接相互作用导致膜的渗透性 增强,细菌允许 Cu2+进入细胞内,引起接触杀菌[73]。 经过激光选区熔化形成的 Ti-3Cu 合金的抗菌率相对于相同成分的铸造合金,抗菌率提高约 70%。
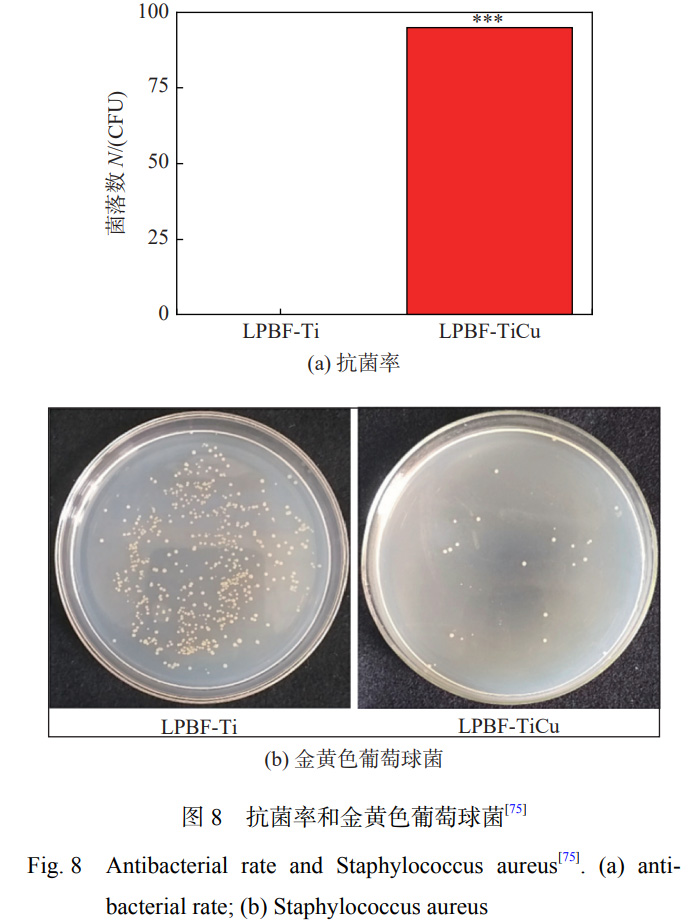
HOU 等学者[74] 通过激光熔覆技术在 TC4 表面原 位制备掺杂 Cu 颗粒的 Ca-Si 基涂层,研究表明:激光处理后原位生成了 Ca2SiO4,CaTiO3 和 Cu2O,涂层表 现出良好的耐磨性和润湿性;当 Cu 含量达到 15%时,复合涂层具有对大肠杆菌最高的抗菌活性。LIU 等 学者[75] 利用激光粉末床熔合(LPBF)技术在纯钛基体 上制备抗菌 Ti-Cu 合金(LPBF-TiCu),激光快速加热 和冷却的优点相对于传统方法制作的 Ti-Cu合金,会 使 Ti 合金形成较多的针状马氏体(α′-Ti),由于其具 有较低的能量状态,会减缓钛合金的腐蚀[76]。Cu 的 加入改善了 LPBF-TiCu 合金中马氏体相变时形状应 变的自适应性,减少了位错在晶界的堆积。LPBFTiCu合金可以显著促进细胞的增殖,合金表面上的 细胞具有更多的伪足,生物相容性良好,对金黄色葡 萄球菌的抑制率达到 94.81%,抗菌效果如图 8 所示。
目前,关于激光熔覆含 Cu 涂层多用于改变金属 的耐磨性和耐腐蚀性[77 − 78],对于采用激光熔覆方式引入 Cu 提高植入物抗菌性能的研究较少。现阶段关 于 Cu2+的杀菌机理主要解释为含铜的抗菌金属材料 在溶液或体液环境下溶出会释放带正电的 Cu2+离子,而细菌的生物膜通常带负电荷,二者之间会产生吸 附作用,从而导致细胞膜上的电荷分布不均匀,细菌 形态在不均匀的库仑力作用下发生变形,细胞膜的 渗透性改变,最终造成细菌壁和细菌膜的破裂,导致 细胞质的溶出,从而杀死细菌[79] 。
3、结束语
(1)激光表面改性诱导钛合金产生抗菌涂层的调 控机理尚不明确,以及如何提升抗菌涂层制造技术 的精确性,促进抗菌性和生物相容性更加协调,是现 阶段钛合金激光表面改性的研究重点。
(2)虽然 Ag,Cu 等抗菌元素的抗菌性已经得到 验证。但是,目前对于金属离子的抗菌机制及细胞 毒性机制的研究尚不明确。不论是通过构建含有抗 菌元素的抗菌涂层还是合金化处理,都需要保证植 入物的长期无害性。因此,可以在保证抗菌元素的 最小添加量下,同时加入多种微量抗菌元素。
(3)对于钛及钛合金的发展,仍然需要对引发炎症 和细菌感染方面投入大量研究。钛合金的植入要在 保证对人体组织长期无害的前提下,构建稳定且多 功能的复合涂层以满足实际应用中的多种需求,是 钛及钛合金在生物医用领域中未来研究的主要方向。
参考文献
[1]vPOU P, RIVEIRO A, DEL VAL J, et al. Laser surface texturing of titanium for bioengineering applications[J].Procedia Manufacturing, 2017, 13: 694 − 701.
[2]DU PLOOY R, AKINLABI E T. Analysis of laser cladding of titanium alloy[J]. Materials Today:Proceedings, 2018, 5(9): 19594 − 19603.
[3]孙壮, 王伟, 王成, 等. 钛合金表面激光熔覆耐磨和自润滑 涂层的研究进展 [J]. 材料保护, 2023,56(1): 107 − 120.
SUN Zhuang, WANG Wei, WANG Cheng, et al. Research progress of wear-resistant and self-lubrication coatings prepared on titanium alloy surface by laser cladding[J]. Material Protection, 2023, 56(1): 107 − 120.
[4]LIU S Y, SHIN Y C. Additive manufacturing of Ti6Al4V alloy: A review[J]. Materials &Design, 2019, 164: 107552.
[5] 吴耀佳, 张懋达, 付永强, 等. 含 Ag 硬质涂层的结构及其摩擦腐蚀与抗菌特性的研究进展 [J]. 表面技术, 2021, 50(1): 94 − 106, 161.
WU Yaojia, ZHANG Maoda, FU Yongqiang, et al. Research progress in structure, tribocorrosion and antibacterial properties of Ag-containing hard coatings[J]. Surface Technology, 2021, 50(1): 94 − 106, 161.
[6]APAZA-BEDOYA K, TARCE M, BENFATTI C A M, et al. Synergistic interactions between corrosion and wear at titanium-based dental implant connections: A scoping review[J]. Journal of Periodontal Research, 2017, 52(6): 946 − 954.
[7]CHAN C W, CARSON L, SMITH G C, et al. Enhancing the antibacterial performance of orthopaedic implant materials by fibre laser surface engineering[J]. Applied Surface Science,2017, 404: 67 − 81.
[8]ZIMMERLI W. Clinical presentation and treatment of orthopaedic implant-associated infection[J]. Journal of Internal Medicine, 2014, 276(2): 111 − 119.
[9]CAMPOCCIA D, MONTANARO L, ARCIOLA C R. The significance of infection related to orthopedic devices and issues of antibiotic resistance[J]. Biomaterials, 2006, 27(11): 2331 −2339.
[10]FLEMMING H C, VAN HULLEBUSCH E D, NEU T R. The biofilm matrix: multitasking in a shared space[J].Nature Reviews Microbiology, 2023, 21(2): 70 − 86.
[11]范竞一, 马迅, 李伟, 等. 医用钛合金表面改性技术研究进 展 [J]. 功能材料, 2022, 53(7): 7027 − 7039.
FAN Jingyi, MA Xun, LI Wei, et al. Research progress of surface modification technology of biomedical titanium alloy[J]. Journal of Functional Materials, 2022, 53(7): 7027 − 7039.
[12]NIE Bin’en, LONG Teng, AO Haiyong, et al. Covalent immobilization of enoxacin onto titanium implant surfaces for inhibiting multiple bacterial species infection and in vivo methicillin-resistant staphylococcus aureus infection prophylaxis[J]. Antimicrobial Agents and Chemotherapy, 2016, 60(1): e01766 − 16.
[13]ALT V, BITSCHNAU A, ÖSTERLING J, et al. The effects of combined gentamicin-hydroxyapatite coating for cementless joint prostheses on the reduction of infection rates in a rabbit infection prophylaxis model[J].Biomaterials, 2006, 27: 4627 − 4634.
[14]DONG Yaning, LIU Li, SUN Jin, et al. Phosphonate/quaternary ammonium copolymers as high-efficiency antibacterial coating for metallic substrates[J]. Journal of Materials Chemistry B, 2021, 9(39): 8321 − 8329.
[15] 秦思民. 基于生物被膜的耐药性抗菌剂研究和工程新材 料探索 [D]. 北京: 中国科学院大学,2022.
QIN Simin. Research on drug-resistant antibacterial agents and exploration of new engineering materials based on biofilms[D]. Beijing, China: University of Chinese Academy of Sciences, 2022.
[16]王东生, 田宗军, 沈理达, 等. 激光熔覆技术研究现状及其 发展 [J]. 应用激光, 2012, 32(6):538 − 544.
WANG Dongsheng, TIAN Zongjun, SHEN Lida, et al. Research status and development of laser cladding technology[J]. Applied Laser, 2012, 32(6): 538 − 544.
[17]崔振铎, 朱家民, 姜辉, 等. Ti 及钛合金表面改性在生物医 用领域的研究进展 [J]. 金属学报,2022, 58(7): 837 − 856.
CUI Zhenduo, ZHU Jiamin, JIANG Hui, et al. Research progress of the surface modification of titanium and titanium alloys for biomedical application[J]. Acta Metallurgica Sinica, 2022,58(7): 837 − 856.
[18]SIDDIQUI A A, DUBEY A K. Recent trends in laser cladding and surface alloying[J]. Optics & Laser Technology, 2021, 134: 106619.
[19]JU Jiang, ZAN Rui, SHEN Zhao, et al. Remarkable bioactivity, bio-tribological, antibacterial, and anti-corrosion properties in a Ti6Al4V-xCu alloy by laser powder bed fusion for superior biomedical implant applications[J].Chemical Engineering Journal, 2023, 471:144656.
[20]张永康, 周建忠, 叶会霞, 等. 激光加工技术 [M]. 北京: 化 学工业出版社, 2006.
ZHANG Yongkang, ZHOU Jianzhong, YE Huixia, et al. Laser processing technology [M]. Beijing,China: Chemical Industry Press, 2006.
[21]SYPNIEWSKA J, SZKODO M. Influence of laser modification on the surface character of biomaterials: Titanium and its alloys-A review[J]. Coatings, 2022, 12: 1371.
[22]LIU Zhifang, NIU Tong, LEI Yaxi, et al. Metal surface wettability modification by nanosecond laser surface texturing: A review[J]. Biosurface and Biotribology, 2022(2): 95 −120.
[23]XU Yong, LIU Wei, ZHANG Gangqiang, et al. Friction stability and cellular behaviors on laser textured Ti6Al4V alloy implants with bioinspired micro-overlapping structures[J].Journal of the Mechanical Behavior of Biomedical Materials, 2020, 109: 103823.
[24]WANG Xinlin, LEI Lei, YU Han. A review on microstructural features and mechanical properties of wheels/rails cladded by laser cladding[J]. Micromachines, 2021, 12(2): 152.
[25] ZHANG Yifu, ZHANG Hua, ZHU Zhengqiang, et al.Microstructure, properties and first principles calculation of titanium alloy/steel by Nd: YAG laser self-fluxing welding[J]. China Welding, 2018, 27(3): 1 − 10.
[26]周佳良, 舒凤远, 赵洪运, 等. 激光熔覆在 AlN 陶瓷表面制 备铜基金属覆层缺陷分析及控制 [J].焊接学报, 2019, 40(11): 133 − 138.
ZHOU Jialiang, SHU Fengyuan, ZHAO Hongyun, et al. Analysis and control of defects in preparing copper-based metal coatings on AlN ceramic surface by laser cladding[J].Transactions of the China Welding Institution, 2019, 40(11): 133 − 138.
[27]袁庆龙, 冯旭东, 曹晶晶, 等. 激光熔覆技术研究进展 [J].材料导报, 2010, 24(3): 112 − 116.
YUAN Qinglong, FENG Xudong, CAO Jingjing, et al. Research progress of laser cladding technology[J]. Materials Reports, 2010, 24(3): 112 − 116.
[28]王垚. 喷射电沉积前处理的激光表面处理方法与试验研 究 [D]. 南京: 南京航空航天大学, 2019.
WANG Yao. Experimental Study on Laser surface treatment method of pre-electrodeposition[D]. Nanjing, China: Nanjing University of Aeronautics and Astronautics, 2019.
[29]林基辉, 刘德鑫, 李耀, 等. 激光合金化技术在表面改性中 的应用研究进展 [J]. 热加工工艺,2020, 49(8): 13 − 16.
LIN Jihui, LIU Dexin, LI Yao, et al. Research Progress in application of laser alloying technology in surface modification[J]. Hot Working Technology, 2020, 49(8): 13 − 16.
[30]QIAO Q, CRISTINO V A M, TAM L M, et al. Characterization of laser surface-alloyed Ti-Ni-Ag coatings and evaluation of their corrosion and antibacterial performance[J]. Surface and Coatings Technology, 2023, 474: 130119.
[31]CHAN C W, LEE S, SMITH G, et al. Enhancement of wear and corrosion resistance of beta titanium alloy by laser gas alloying with nitrogen[J]. Applied Surface Science, 2016, 367: 80 −90.
SANTOS E C, MORITA M, SHIOMI M, et al. Laser gas nitriding of pure titanium using CW and pulsed Nd: YAG lasers[J]. Surface and Coatings Technology, 2006, 201: 1635 − 1642.
[32]邹洁,陈洁, 胡滨. TiN 涂层对牙科钴铬合金抗菌腐蚀性能 的影响 [J]. 上海口腔医学, 2010, 19(2): 173 − 177.
[33] ZOU Jie, CHEN Jie, HU Bin. Effect of titanium nitride coating on bacterial corrosion resistance of dental Co-Cr alloy[J]. Shanghai Journal of Stomatology, 2010, 19(2): 173 − 177.
[34] DONAGHY C L, MCFADDEN R, KELAINI S, et al. Creating an antibacterial surface on beta TNZT alloys for hip implant applications by laser nitriding[J]. Optics & Laser Technology,2020, 121: 105793.
[35]肖忆楠, 乔岩欣, 李月明, 等. 医用钛及钛合金表面改性技 术的研究进展 [J]. 材料导报, 2019,33(Z2): 336 − 342.
XIAO Yinan, QIAO Yanxin, LI Yueming, et al. Research development of surface modification technology of biomedical titanium and titanium alloy[J]. Materials Reports, 2019, 33(Z2): 336 −342.
[36]FATHI-HAFSHEJANI P, JOHNSON H, AHMADI Z, et al. Phase-selective and localized TiO2 coating on additive and wrought titanium by a direct laser surface modification approach[J]. ACS Omega, 2020, 5(27): 16744 − 16751.
[37]PARMAR V, KUMAR A, SANKAR M M, et al. Oxidation facilitated antimicrobial ability of laser micro-textured titanium alloy against gram-positive Staphylococcus aureus for biomedical applications[J]. Journal of Laser Applications, 2018, 30(3): 032001.
[38]CUNHA A, ELIE A M, PLAWINSKI L, et al. Femtosecond laser surface texturing of titanium as a method to reduce the adhesion of Staphylococcus aureus and biofilm formation[J]. Applied Surface Science, 2016, 360: 485 − 493.
[39]VARIOLA F, YI J H, RICHERT L, et al. Tailoring the surface properties of Ti6Al4V by controlled chemical oxidation[J]. Biomater, 2008, 29(10): 1285 − 1298.
[40]李华晨, 周广涛, 陈梅峰, 等. 分步气体介质下低功率激光 焊接薄板紫铜成形及组织和性能 [J].焊接学报, 2020, 41(10): 65 − 72.
LI Huachen, ZHOU Guangtao, CHEN Meifeng, et al. Research on laser welding formability and microstructure property of copper in stepwise gas medium[J]. Transactions of the China Welding Institution, 2020, 41(10): 65 − 72.
[41]GALLARDO-MORENO A M, PACHA-OLIVENZA M A, SALDAÑA L, et al. In vitro biocompatibility and bacterial adhesion of physico-chemically modified Ti6Al4V surface by means of UV irradiation [J]. Acta Biomaterialia, 2009, 5(1): 181 − 192.
[42]MITIK-DINEVA N, WANG J, TRUONG V K, et al. Escherichia coli, Pseudomonas aeruginosa, and Staphylococcus aureus attachment patterns on glass surfaces with nanoscale roughness[J].Current Microbiology, 2009, 58: 268 − 273.
[43]JEYACHANDRAN Y L, NARAYANDASS S K. The effect of thickness of titanium nitride coatings on bacterial adhesion[J]. Trends in Biomaterials and Artificial Organs, 2010, 24(2): 90 − 93.
[44] GIRALDEZ M J, RESUA C G, LIRA M, et al. ContactLens hydrophobicity and roughness
effects on bacterial adhesion[J]. Optometry and Vision Science, 2010, 87(6): E426 − E431.
[45]POGODIN S, HASAN J, BAULIN V A, et al. Biophysical model of bacterial cell interactions
with nanopatterned cicada wing surfaces[J]. Biophysical Journal, 2013, 104(4): 835 − 840.
[46]TRUONG V K, LAPOVOK R, ESTRIN Y S, et al. The influence of nano-scale surface roughness
on bacterial adhesion to ultrafine-grained titanium[J]. Biomaterials, 2010, 31(13): 3674 −
3683.
[47]BRAEM A, VAN MELLAERT L, MATTHEYS T, et al. Staphylococcal biofilm growth on smooth and
porous titanium coatings for biomedical applications[J]. Journal of Biomedical Materials
Research Part A, 2014, 102: 215 − 224.
[48]司银芳, 胡语婕, 张凡, 等. 生物合成氧化锌纳米颗粒材料 及其抗菌应用 [J]. 化工进展, 2023, 42(4): 2013 − 2023.
SI Yinfang, HU Yujie, ZHANG Fan, et al. Biosynthesis of zinc oxide
nanoparticles and its application to antibacterial[J]. Chemical Industry and Engineering
Progress, 2023, 42(4): 2013 − 2023.
[49]许晴. 生物活性陶瓷复合材料制备及其抗菌和再生修复 研究 [D]. 北京: 中国科学院大学, 2021. XU Qing. Preparation of bioactive ceramic composites and its antibacterial activity and regenerative repair effect[D]. Beijing, China: University of Chinese Academy of Sciences,2021.
[50]ZHOU Yazhou, YANG Juan, HE Tingting, et al. Highly stable and dispersive silver nanoparticle-graphene composites by a simple and low-energy-consuming approach and their antimicrobial activity[J]. Small, 2013, 9(20): 3445 − 3454.
[51]SHI Anqi, ZHU Chenshun, FU Shan, et al. What controls the antibacterial activity of Ti-Ag alloy, Ag ion or Ti2Ag particles?[J]. Materials Science and Engineering: C, 2020, 109:110548.
[52]CHEN Mian, YANG Lei, ZHANG Lan, et al. Effect of nano/micro-Ag compound particles on the bio-corrosion, antibacterial properties and cell biocompatibility of Ti-Ag alloys[J].Materials Science and Engineering: C, 2017, 75: 906 − 917.
[53]XUE Xianda, LU Libin, HE Donglei, et al. Antibacterial properties and cytocompatibility of Ti-20Zr-10Nb-4Ta alloy surface with Ag microparticles by laser treatment[J]. Surface and Coatings Technology, 2021, 425: 27716.
[54] ZHANG Yanzhe, LIU Xiangmei, LI Zhaoyang, et al. Nano Ag/ZnO-incorporated hydroxyapatite composite coatings: highly effective infection prevention and excellent osteointegration[J].ACS Applied Materials & Interfaces, 2018, 10(1): 1266 − 1277.
[55]丁婷婷. 含银纳米材料的制备、抗菌性能及细胞毒性研 究 [D]. 长沙: 湖南大学, 2020.
DING Tingting. Preparation, antibacterial properties and cytotoxicity of silver-containing nanomaterials[D]. Changsha, China: Hunan University, 2020.
[56]MAHARUBIN S, HU Y B, SOORIYAARACHCHI D. Laser engineered net shaping of antimicrobial and biocompatible titanium-silver alloys[J]. Materials Science and Engineering: C, 2019, 105:110059.
[57]李波. 基于银基纳米复合生物材料靶向协同抗菌用于骨 感染治疗 [D]. 上海: 东华大学, 2022.
LI Bo. Targeted synergistic antibacterial based on silverbased nanocomposite biomaterials for bone infection treatment[D]. Shanghai, China: Donghua University, 2022.
[58]SHI Pengyan, SUN Haoliang, ZHANG Haoge, et al. Highly effective antibacterial properties of self-formed Ag nanoparticles/Zr-Ag granular films[J]. Applied Surface Science, 2023, 622: 156929.
[59]ABBASZADEGAN A, GHAHRAMANI Y, GHOLAMI A, et al. The effect of charge at the surface of silver nanoparticles on antimicrobial activity against gram-positive and gram-negative bacteria: A preliminary study[J]. Journal of Nanomaterials, 2015, 2015: 720654.
[60]RAFFI M, HUSSAIN F, BHATTI T M, et al. Antibacterial characterization of silver nanoparticles against E. coli ATCC15224[J]. Journal of Materials Science & Technology, 2008,24(2): 192 − 196.
[61]张俊敏. Ti-Ta-Ag 合金的放电等离子体烧结合成机理及 其性能研究 [D]. 昆明: 昆明理工大学,2022.
ZHANG Junmin. Study on the synthesis mechanism and properties of Ti-Ta-Ag alloy by spark plasma sintering[D]. Kunming, China: Kunming University of Science and Technology, 2022.
[62]KIM S, LEE H S, RYU D, et al. Antibacterial activity of silver-nanoparticles against Staphylococcus aureus and Escherichia coli[J]. Korean Journal of Microbiology & Biotechnology,2011, 39(1): 77 − 85.
[63]FENG Q L, WU J, CHEN G Q, et al. A mechanistic study of the antibacterial effect of silver ions on Escherichia coli and Staphylococcus aureus[J]. Journal
of Biomedical Materials Research, 2000, 52(4): 662 − 668.
[64]罗娟. 纳米 Ag-Cu 基抗菌材料的制备及其性能研究 [D].昆明: 昆明理工大学, 2022.
LUO Juan. Preparation and properties of nano Ag-Cu based antibacterial materials[D]. Kunming, China: Kunming University of Science and Technology, 2022.
[65]SRIKANT P, REDDY C K, RAM N R. Metallic particulates for preparation of anti-bacterial preservation vassals and their applications-A review[J]. Materials Today:Proceedings, 2019, 18: 440 − 444.
[66]ZHANG Erlin, FU Shan, WANG Ruoxian, et al. Role of Cu element in biomedical metal alloy design[J]. Rare Metals, 2019, 38(6): 476 − 494.
[67]ZHANG Erlin, LI Shengyi, REN Jing, et al. Effect of extrusion processing on the microstructure, mechanical properties, biocorrosion properties and antibacterial properties of Ti-Cu sintered alloys[J]. Materials Science and Engineering: C, 2016, 69: 760 − 768.
[68]LIU Jie, LI Fangbing, LIU Cong, et al. Effect of Cu content on the antibacterial activity of titanium-copper sintered alloys[J]. Materials Science and Engineering: C, 2014, 35: 392 − 400.
[69]FOWLER L, JANSON O, ENGQVIST H, et al. Antibacterial investigation of titanium-copper alloys using luminescent Staphylococcus epidermidis in a direct contact test[J].Materials Science and Engineering: C, 2019, 97: 707 − 714.
[70]BAO Mianmian, LIU Ying, WANG Xiaoyan, et al. Optimization of mechanical properties, biocorrosion properties and antibacterial properties of wrought Ti-3Cu alloy by heat treatment[J]. Bioactive Materials, 2018, 3(1): 28 − 38.
[71]ZHANG Erlin, REN Jing, LI Shengyi, et al. Optimization of mechanical properties, biocorrosion properties and antibacterial properties of as-cast Ti-Cu alloys[J].Biomedical Materials, 2016, 11: 065001.
[72]JI Hairui, ZHAO Mingchun, XIE Bin, et al. Corrosion and antibacterial performance of novel selective-laser-melted (SLMed) Ti-xCu biomedical alloys[J]. Journal of Alloys and Compounds, 2021, 8644: 158415.
[73]PENG Cong, ZHANG Shuyuan, SUN Ziqing, et al. Effect of annealing temperature on mechanical and antibacterial properties of Cu-bearing titanium alloy and its preliminary study of antibacterial mechanism[J]. Materials Science and Engineering: C, 2018, 93: 495 − 504.
[74]HOU Baoping, YANG Zhao, YANG Yuling, et al. In vitro bioactivity, tribological property, and antibacterial ability of Ca-Si-based coatings doped with cu particles in-situ fabricated by laser cladding[J]. Applied Physics A, 2018, 124: 256.
[75]LIU Hui, SHI Lizhen, LIU Huan, et al. Corrosion behavior of laser powder bed fusion prepared antibacterial Cu-bearing titanium alloy[J]. Materials Letters, 2023, 331: 133496.
[76]KASCHEL F R, KEAVENEY S, DOWLING D P. Comparison between continuous and modulated wave laser emission modes for the selective laser melting of Ti-6Al-4V: Dimensional accuracy,microstructure and mechanical behaviour[J]. Additive Manufacturing, 2022, 55: 102825.
[77]谢发勤, 何鹏, 吴向清, 等. 钛合金表面激光熔覆技术的研 究及展望 [J]. 稀有金属材料与工程,2022, 51(4): 1514 − 1524.
XIE Fanqin, HE Peng, WU Xiangqing, et al. Research and prospect of laser cladding technology on titanium alloy surface[J]. Rare Metal Materials and Engineering,
2022, 51(4): 1514 − 1524.
[78]黄湘湘. 碳钢表面激光熔覆铝青铜合金组织和性能研究[D]. 上海: 上海交通大学, 2019.
HUANG Xiangxiang. Microstructure and properties of laser cladded aluminum bronze coating on carbon steel[D]. Shanghai, China: Shanghai Jiao Tong University, 2019.
[79]王亚迪. 基于阳离子-π 作用的铜复合物的抗菌性能与机 理研究 [D]. 北京: 中国科学院大学,2020.
WANG Yadi. Copper complexes based on cation-π interaction: Preparation characterization and antimicrobial activities[D]. Beijing, China: University of Chinese Academy of Sciences,2020.
第一作者: 马振,博士,副教授;主要从事医用钛合金表面 改性的科研和教学工作;已发表论文 20 余篇;jmsdxmz@163.com。通信作者: 牟立婷,博士,副教授;主要从事医用生物材料 研究;muliting@163.com。
相关链接
















